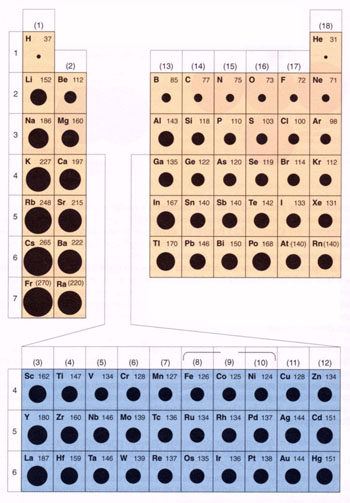
PROPRIETA' PERIODICHE, NUMERO DI OSSIDAZIONE E FORMULE DEI COMPOSTI BINARI Prima di "avventurarci" nell'affascinante mondo della nomenclatura chimica è utile tenere bene a mente alcune proprietà degli elementi che si possono ben evidenziare grazie alla tavola periodica.
Anzi direi che la tavola periodica e il Altra cosa fondamentale di cui tenere conto è la differenza tra elettroni di valenza ed elettroni di legame. Gli ELETTRONI DI VALENZA sono tutti gli elettroni presenti negli orbitali s e p a numero quantico principale più alto. Gli elettroni di valenza sono elettroni che un atomo PUÒ usare per legarsi con un altro atomo (può usare significa che non è detto che li usi tutti) Gli ELETTRONI DI LEGAME sono gli elettroni che un atomo EFFETTIVAMENTE usa per legarsi con un altro atomo. Vedremo che quando due atomi si legano si "prestano", si "scambiano" o "mettono in compartecipazione" degli elettroni. Facciamo un esempio: Tenete anche bene a mente la "famosa" regola dell'ottetto. Gli atomi che hanno 8 elettroni degli orbitali s e p a numero quantico principale più alto, come i gas nobili, assumono una configurazione particolarmente stabile. Possiamo quindi dire che il "sogno nel cassetto" di tutti gli atomi, quello che ogni elemento chimico disperatamente vuole, è avere 8 elettroni negli orbitali s e p più esterni. Quando gli atomi di legano e si scambiano elettroni lo faranno cercando di ottenere un bellissimo ottetto (o almeno cercheranno di avvicinarsi). Due proprietà degli elementi da tenere ben presenti per capire quello che stiamo facendo sono l'elettronegatività e il numero di ossidazione. ELETTRONEGATIVITA' E' una misura relativa della capacità di un atomo di attrarre elettroni quando prende parte ad un legame chimico.
L'elettronegatività aumenta in ogni periodo da sinistra a destra e diminuisce in ogni gruppo dall'alto verso il basso.
ENERGIA DI IONIZZAZIONE L'energia di ionizzazione è l'energia necessaria per estrarre un elettrone da un atomo allo stato gassoso. Essa, come potete intuire, è legata al volore della elettronegatività, se infatti un atomo è altamente elettronegativo e quindi attira fortemente elettroni sarà difficile toglierlene uno, mentre atomi scarsamente elettronegativi si faranno togliere elettroni con maggiore facilità. L' energia di prima ionizzazione (cioè quella necessaria per strappare un solo elettrone) dipende strettamente dalla configurazione elettronica degli atomi, per cui ha un tipico andamento periodico: le energie di ionizzazione degli atomi crescono da sinistra verso destra, diminuiscono dall’alto verso il basso nell’interno di un gruppo (esattamente come l'elettronegatività).
Naturalmente, dopo aver tolto un elettrone ad un atomo, posso toglierlene un altro, o altri due. Si parla in questo caso di energia di seconda ionizzazione, terza ionizzazione e così via. Naturalmente devo spendere sempre più energia, fino al momento in cui non sarà proprio più possibile strappare altri elettroni.
NUMERO DI OSSIDAZIONE Il numero di ossidazione (o stato di ossidazione) di un elemento chimico in un composto dipende dal numero di elettroni ceduti o acquistati virtualmente durante la formazione di un composto. Esso corrisponde alla ipotetica carica che ogni atomo presente in
una formula neutra o ionica, acquisterebbe in seguito
all’attribuzione degli elettroni di legame all'atomo più elettronegativo.
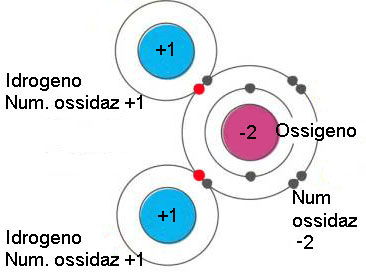
In realtà l'idrogeno non ha perso il suo elettrone, si può dire che lo ha messo in compartecipazione con l'ossigeno, allo stesso modo l'ossigeno presta un elettrone a ciascuno dei due atomi di idrogeno. Le coppie di elettroni di legame (palline nere e rosse) possono orbitare sia intorno all'idrogeno che intorno all'ossigeno (vedremo poi che in realtà si trovano più spesso dalle parti dell'ossigeno). Per il calcolo del numero di ossidazione però gli elettroni di legame si considerano assegnati all'atomo più elettronegativo, in questo caso l'ossigeno.
L'idrogeno quindi è come se perdesse il proprio elettrone e acquistasse l'ipotetica carica di +1 (numero di ossidazione dell'idrogeno). L'ossigeno acquista virtualmente due elettroni, la sua ipotetica carica diventa quindi -2 (numero di ossidazione dell'ossigeno).
COME SCRIVERE LA FORMULA DI UN COMPOSTO BINARIO Abbiamo visto che il "sogno nel cassetto" di ogni atomo è quello di assomigliare il più possibile ad un gas nobile e riuscire ad avere otto elettroni negli orbitali s e p più esterni. Per riuscirci ogni atomo deve o prestare o farsi prestare o magari rubare elettroni. Il cloro ad esempio può avere diversi numeri di ossidazione -1, +1, +3, +5, +7. Questo significa che quando forma un composto con il numero di ossidazione -1 si farà dare 1 elettrone da qualcuno, mentre se forma un composto con il numero di ossidazione + 7 significa che darà via 7 elettroni. Il sodio ha un solo numero di ossidazione che è +1 questo significa che per formare un legame (stiamo parlando di legami ionici o covalenti) deve trovare qualcuno a cui "regalare" il suo elettrone. RICORDATEVI: Che succede se cloro e sodio si incontrano? Il sodio può solo regalare un elettrone e il cloro (con numero di oss. -1) è disposto a farsi dare un elettrone quindi cloro e sodio stanno benissimo insieme e si lagano formando il cloruro di sodio NaCl. La somma infatti dei numeri di ossidazione è uguale a zero. Che succcede se il coloro incontra il calcio? Un atomo di calcio è un metallo alcalino terroso ed il suo numero di ossidazione è sempre +2. questo significa che un atomo di calcio deve "regalare" 2 elettroni. Ora abbiamo visto che un atomo di cloro è disposto a prendere un elettrone (n.o. -1), ma non è disposto a prenderne due, infatti il cloro non ha mai numero di ossidazione -2. Come si risolve la faccenda? Semplice, un atomo ci calcio ha bisogno di due atomi di cloro. Il calcio regala i suoi due elettroni (n.o. +2) e ciascuno dei due atomi di cloro prende un solo elettrone (n.o. -1). La formula sarà CaCl2,(somma dei numeri di ossidazione =0). Che succede se il calcio incontra l'ossigeno? Il nostro atomo di calcio cerca sempre di regalare due elettroni a qualcuno, ma un atomo di ossigeno, che ha numero di ossidazione -2 cerca appunto qualcuno da cui farsi dare due elettroni. In questo caso la formula sarà CaO (somma dei numeri di ossidazione =0). Che succede se l'ossigeno incontra il sodio? Questa volta è l'ossigeno che ha bisogno di due atomi di sodio. L'ossigeno infatti vuole due elettroni (n.o. -2) e ciascun atomo di sodio ne ha solo uno da regalare (n.o. +1). La formula sarà Na2O (somma dei numeri di ossidazione =0).
ALCUNE SEMPLICI REGOLE Se non volete stare a fare ogni volta tanti ragionamenti, ecco alcune semplici regole per scrivere la formula di un composto binario. DUE ELEMENTI CHE ABBIANO NUMERO DI OSSIDAZIONE DELLO STESSO SEGNO NON POSSONO LEGARSI (con legame ionico o covalente). Nota: i metalli possono tranquillamente legarsi tra loro grazie al legame metallico COME SI SCRIVE LA FORMULA DI UN COMPOSTO BINARIO? ESEMPIO Cloro: numero di ossidazione -1 formeranno => Ca1Cl2 Che possiamo scrivere CaCl2 Dicloruro di calcio Zolfo: numero di ossidazione -2 formeranno => Mo2S6 Che possiamo scrivere semplificando MoS3 Trisolfuro di molibdeno
|
||||||
 Le regole per determinare il numero di ossidazione:
Le regole per determinare il numero di ossidazione: